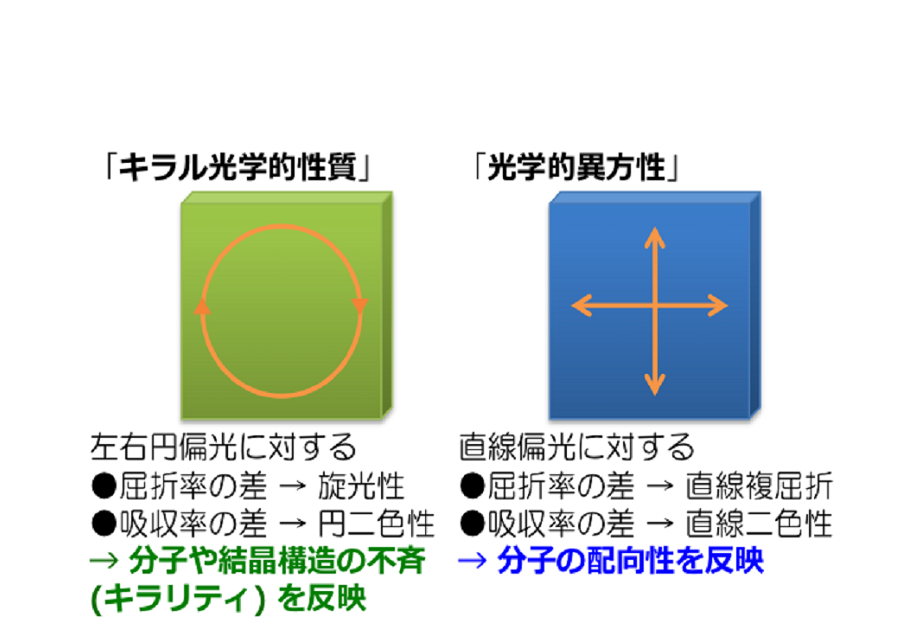
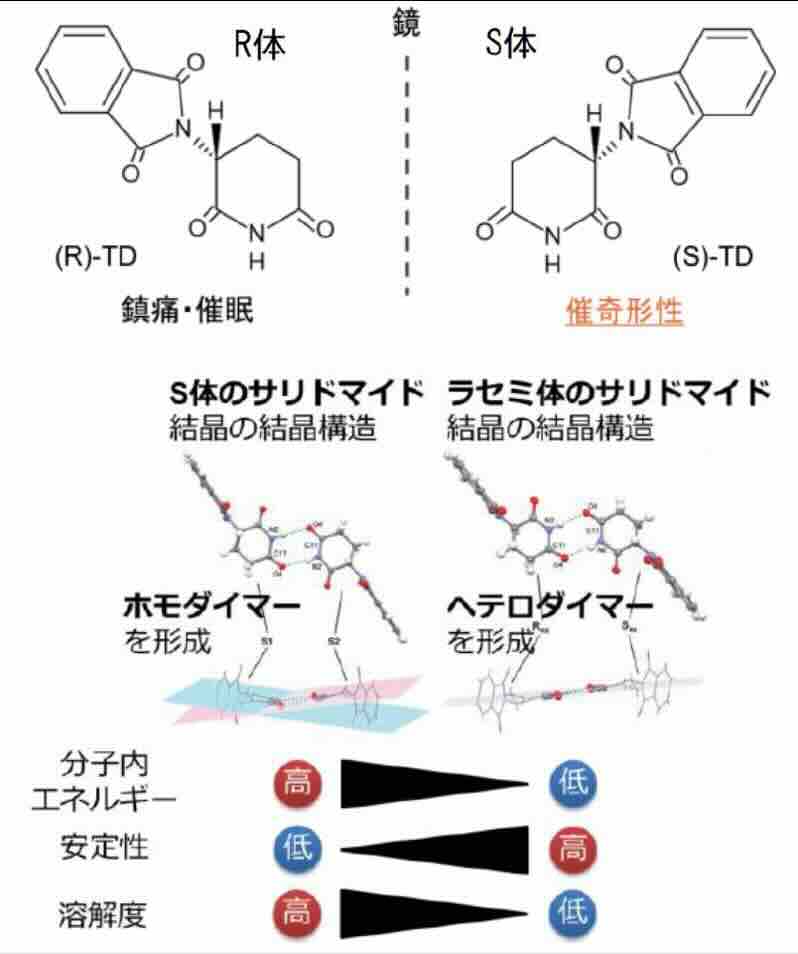
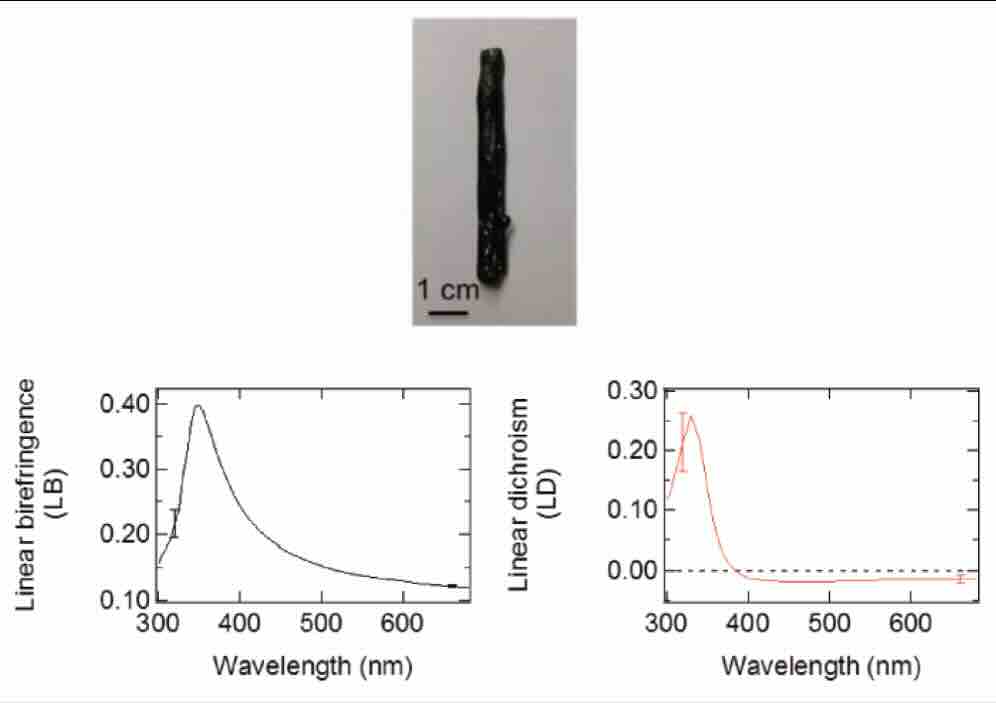
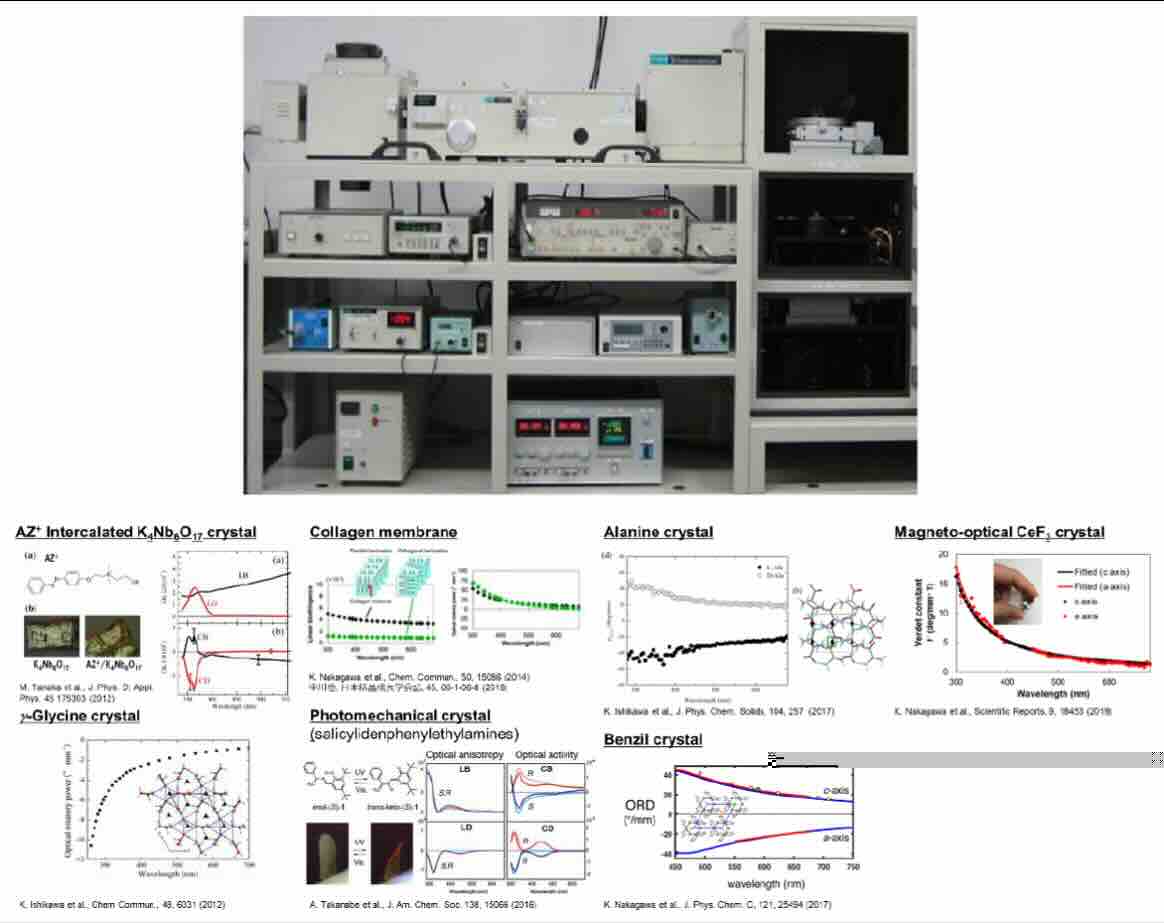
関連論文
[1] J. Kobayashi et al., J. Appl., Cryst., 16, 204-211 (1983).
[2] J. Kobayashi, T. Asahi et al., Phys. Rev. B, 53, 11784 (1996).
[3] M. Tanaka, T. Asahi et al., J. Phys. Appl. Phys., 45, 175303-175311
[4] T. Asahi, K. Nakagawa et al., Chiroptical Studies on Anisotropic Condensed Matter: Principle and Recent Applications of the Generalized-High Accuracy Universal Polarimeter. Crystal Growth Technologies and Applications, IntechOpen (2022).
[5] K. Ishikawa, T. Asahi et al., Chem. Commun., 48, 6031-6033 (2012).
[6] K. Ishikawa, T. Asahi et al., J. Phys. Chem. Solids, 104, 257-266 (2017).
[7] K. Nakagawa, B. Kahr, T. Asahi et al., J. Phys. Chem. C, 121, 25494-25502 (2017).
[8] K. Nakagawa, T. Asahi et al., Chem. Commun., 50, 15086-15089 (2014).
[9] A. Takanabe, H. Koshima, T. Asahi, J. Am. Chem. Soc., 138, 15066-15077 (2016).
[10] K. Nakagawa, T. Asahi, Sci. Rep., 9, 18453 (2019).